 NOVA ŽIVILA V EVROPSKI UNIJI (EU)
NOVA ŽIVILA V EVROPSKI UNIJI (EU)
V EU so nova živila (NŽ) v skladu z Uredbo (EU) 2015/2283 razvrščena med izdelke, ki se v EU niso veliko uživali pred majem 1997. Teh živil ni mogoče dati v promet pred odobritvijo s strani Evropske komisije (EK).
Za umestitev CBD izdelkov, ki so razvrščeni kot nova živila na trg EU, mora nosilec živiske dejavnosti pri EK vložiti vlogo za dovoljenje za ta izdelek. Obdelava vloge je zapletena in je sestavljena iz naslednjih korakov:
- V začetnem koraku Evropska komisija (EK) in Evropska agencija za varnost hrane (EFSA) izvedeta preverjanje veljavnosti vložene vloge NŽ. Ko prijavitelj predloži vse zahtevane podatke, se potrdi validacija prijave NŽ.
- Naslednji korak je ocena tveganja s strani EFSA, ki jo običajno zahteva EK. EFSA izrazi svoje mnenje o novem živilu v 9 mesecih, če v tej fazi ni dodatnih zahtev organov.
- V 7 mesecih po mnenju EFSA EK predloži osnutek izvedbenega akta, ki dovoljuje zakonito dajanje NŽ na trg.
- Ko akt prejme pozitivno glasovanje stalnega odbora in ga sprejme EK, se lahko NŽ zakonito da na trg EU.
 NOVA ŽIVILA V ZDRUŽENEM KRALJESTVU (ZK)
NOVA ŽIVILA V ZDRUŽENEM KRALJESTVU (ZK)
Sistem avtorizacije NŽ je v Združenem kraljestvu podoben, kar zadeva zakonodajo o NŽ. Ko pa gre za CBD izdelke, se je Agencija za standarde hrane (FSA) odločila ravnati nekoliko drugače.
Oblasti so 13. februarja 2020 objavile, da morajo podjetja, ki prodajajo izdelke CBD v Združenem kraljestvu, predložiti in imeti validirano vlogo za NŽ do 31. marca 2021. Po tem datumu bi lahko le validirana NŽ ostala na trgu.
To se je spremenilo marca 2021, ko je FSA objavila, da morajo podjetja vloge za NF le oddati do konca marca 2021.
FSA je vzpostavila tudi tako imenovani »javni seznam«, ki zagotavlja javne informacije o prijaviteljih, ki imajo veljavne prijave NŽ. FSA jasno navaja, da postopek poteka vzporedno s postopkom validacije aplikacij NŽ, ki trenutno potekajo, in ne vpliva na izid statusa validacije.
Trenutno lahko vsa podjetja prodajajo svoje izdelke CBD v Združenem kraljestvu, če niso napačno označeni, niso nevarni in so zajeti v ustreznih NŽ vlogah, ki so bile predložene pred marcem 2021.
PHARMAHEMP – STATUS ODDANIH VLOG ZA AVTORIZACIJO NOVEGA ŽIVILA
Smo v postopku registracije dveh novih živilskih sestavin, in sicer kanabidiola (CBD) in ekstrakta Cannabis sativa L. Obe vlogi sta bili v letih 2020 in 2021 predloženi Evropski komisiji v EU in FSA v Združenem kraljestvu.
Trenutni status EK:
Vložena vloga za novo živilo za CBD (2020/2066) = VALIDIRANA od februarja 2022
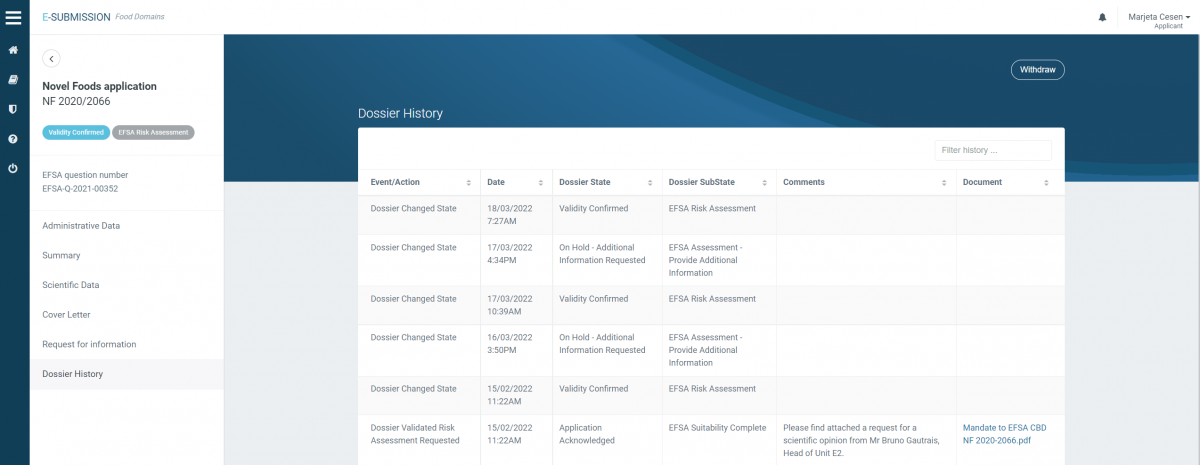
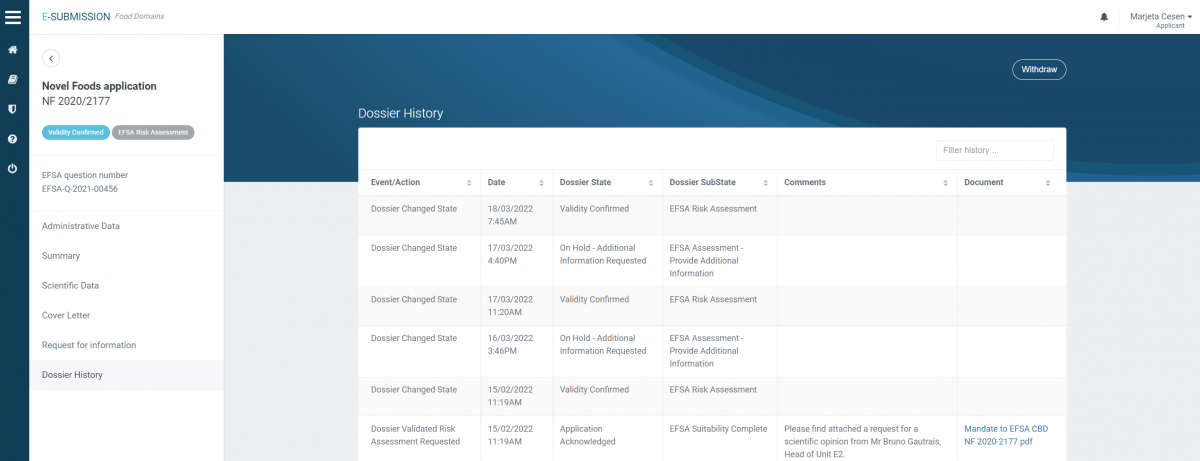
Status vloženih vlog za novo živilo je javno dostopen na OpenEFSA Portal-u.
Trenutno stanje v Združenem kraljestvu:
Vložena vloga za novo živilo za ekstrakt Cannabis sativa L. (RP-821) = validirana (v fazi ocene tveganja).
545 produktov, ki so vezani na PharmaHempovo vlogo za odobritev novega živila (RP-821) je navedenih na CBD Public list, ki jo je vzpostavila Food Standards Ageny.










